臨床研究と臨床試験、治験はそれぞれ定義が若干異なります。以下画像のように、それぞれが入れ子構造になっているのです。

この記事では、病気の原因を解明し、有効な治療方法を確立するために不可欠な臨床研究・臨床試験・治験についてご説明します。
臨床研究とは?
臨床研究は人を対象とするすべての医学研究を指します。
臨床研究は大きく「症例報告・調査・臨床試験」に分類されており、つぎに詳しく解説する臨床試験と治験も臨床研究の一部です。
当サイト「ぺいるーと」の募集例としては、具体的なカテゴリがあるわけではなく多種多様ですが、例えば高血圧の方に既存の高血圧の薬を服用していただきながら、機器を装着していただくモニターなどがあります。
臨床試験とは?
臨床試験は「前向き研究」と「介入」を行う、人を対象として行う治療を兼ねた試験を指します。
「前向き研究」は、これから生じる現象を研究する行為です。
たとえばある薬物の投与後、長期にわたる追跡調査でどのような効果が得られるか検証する行為は「未来に生じる現象の研究」であるため前向き研究に分類されます。
※過去に生じた現象の研究は後ろ向き研究と呼びます。
そして「介入」は、研究を目的として意図的に何らかの影響を及ぼす診療行為を指します。介入と定義される行為の一例は以下の通りです。
- 健康の保持増進につながる行為
- 医療における疫病の予防
- 診断または治療のための投薬・検査等
より馴染みのある行為で例えると生活や食事、運動や禁煙などに対する指導も介入の一種です。
ただし介入は一般的な診療とは異なり、ときには研究目的のために「未承認医薬品・未承認医療機器」や「承認範囲を超えた医薬品・機器・医療行為」を使ったり、美容整形など体の構造や機能に影響を与えたりといった行為も含まれます。
当サイト「ぺいるーと」での具体的な募集例としては、健康食品モニターや化粧品モニターがこちらにあたります。
治験とは?
治験は「新しい医薬品や医療機器の製造・販売承諾を得る」ことを目的とした臨床試験を指します。
普段意識する機会は少ないかもしれませんが、私たちが利用している医薬品や医療機器は治験を通じて安全性と有効性を証明され、規制当局(厚生労働省)の承認を受けたものです。
ですから、当サイト『ぺいるーと』に掲載している「通院の治験」や「入院の治験」は、いずれも新しく生まれる薬を厚生労働省へ送り出すための取り組みの一環なのです。
なお、化粧品や健康食品の効果検証に協力する試験は、治験ではなく臨床試験に該当します。有料ボランティアのモニターとして参加し、謝礼金を得られる点では治験と似ていますが、実施する背景や目的は異なるのです。
治験やその他の臨床試験の報酬に関する基本情報は、それぞれ以下の記事にまとめました。モニターとしての参加に興味がある方は、予習代わりにぜひご一読ください。
治験とは?参加にかかる費用や報酬、メリット・デメリットを分かりやすく解説
日帰り治験特集!通院治験や化粧品・健康食品モニターが気になる方は必見
新しい医薬品ができるまでの工程
日本国内では毎年40~50種類ほどの新しい薬が生まれていますが、薬は数ヶ月や数年といった短い期間で開発できるものではありません。
1つの薬ができるまでにかかる歳月は9~17年です。それだけの長い時間、約200~500億円を投じて研究・開発を進めるのですが、以下の画像にあるプロセスを経て実用可能となる薬はごく一部です。
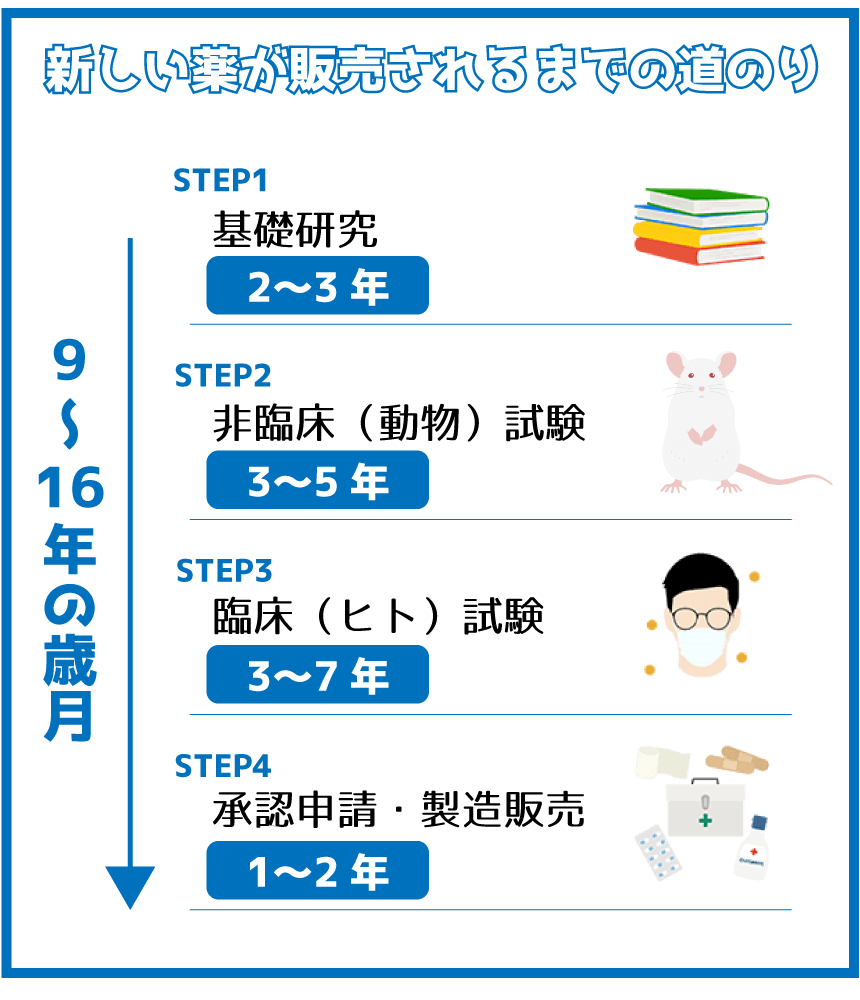
これらの工程を経て「創薬」が成功する確率は約25,000分の1ともいわれます。候補となった物質のたった0.0025%程度しか、実際に薬として流通しないのです。
この事実だけでも、新しい薬を誕生させることが非常に難しいものだと分かりますが、本章ではさらに「各工程でどのような研究開発が行われているのか」をご紹介します。
基礎研究(2~3年)
動植物や鉱物などの天然素材から抽出した成分や、化学合成やバイオテクノロジーなどの技術を活用し、怪我や病気に対する有効成分の候補を探す段階です。
非臨床試験(3~5年)
非臨床試験では動物や人由来の細胞・組織、または生きた動物に対して以下の試験を行います。
| 項目 | 概要 |
| 薬効薬理試験 | 候補薬の効果を検証する試験 |
| 薬物動態試験 | 物質を投与したあとの体内動態(吸収・分布・代謝・排泄)を明らかにする試験 |
| 毒性試験 | 生体に好ましくない作用を解析する試験 |
ただし、非臨床試験だけでは安全性・有効性を十分に検証できません。
というのも、薬は投与対象が変わると毒性や有効性が変わりますし、医療機器も臓器の大きさや形状が異なる動物と人間では得られる結果が異なる可能性があるからです。そのため、非臨床試験のあとには人間を対象とした臨床試験が行われます。
臨床試験(3~7年)
医薬品の認証を受けるための臨床試験(治験)では、健康な成人や患者を対象に第Ⅰ相・第Ⅱ相・第Ⅲ相の段階を経て、候補となる薬の有効性や安全性を調べます。
第Ⅰ相試験
動物で検証した薬を初めて人体に投与する試験。女性は妊娠の可能性があるため、基本的に健康な成人男性を対象に行われます。
投与量を徐々に増やす「漸増法」や決まった用量を定期的に投与する「反復投与試験」などを通じ、投与された薬がどのように吸収され、分布・代謝・排泄されるのか解析するための工程です。
健康な成人男性を対象に行う背景には以下の理由があります。
- 参加者を短期間で集めやすい
- 頻繁な採血などの検査に耐えられる
- ほかの薬剤を服用している可能性が低い
なお、場合によっては女性や軽度の患者を対象に行う第Ⅰ相試験もあります。とくに抗がん剤の場合は健康な人体を害する懸念があるため、第Ⅰ相試験から患者を対象にします。
第Ⅱ相試験
第Ⅰ相試験で安全性が確認された治験薬を使い、少数の患者を対象として行われる試験。より大勢の患者で実施することになる第Ⅲ相試験に向けて、あらかじめ適切な用法用量を解析することが第Ⅱ相試験の目的です。
以上の特性から「探索的臨床試験」とも呼ばれており、低用量の投与からスタートして段階的に患者数・投与期間・投与量を上げていく特徴があります。
また第Ⅱ相試験では、医師・患者ともに治験薬かプラセボ(偽薬)か知らされない状態で試験を行う「二重盲検法」が行われることも多々あります。
第Ⅲ相試験
少数の患者を対象にしていた第Ⅱ相試験より、さらに被験者の年齢や重症度の幅を広げて有効性と安全性を検証する試験。実際の治療に近い形で投与して副作用や他剤との相互作用などを評価し、承認の根拠となるデータを収集することが目的です。
承認申請・製造販売(1~2年)
試験により安全性・有効性・品質が証明された薬は、厚生労働省の承認を得るための申請を行います。
厚生労働省が医薬品医療機器総合機構へ依頼した審査が通過したあと、薬事・食品衛生審議会の審議を経て、厚生労働大臣の許可が下りれば製造販売が可能となります。
製造販売後調査
承認を得た医薬品や医療機器を対象に実施される、有効性と安全性を確認するための調査が製造販売後調査(PMS)です。
| 項目 | 概要 |
| 使用成績調査 | 調査対象となる患者を限定せず、副作用や有効性、安全性などの情報を確認する調査 |
| 特定使用成績調査 | 調査対象を小児や高齢者など特定の条件で限定し、医薬品の情報を確認する調査 |
| 製造販売後臨床試験 | 承認・製造販売後に行われる、日常の診療では得られない医薬品の情報を収集する調査 |
上記の調査により、臨床試験では得られなかった情報を収集し、その調査結果は厚生労働省へ報告して再審査の材料として使われます。
モニター参加で創薬に貢献しつつ報酬を受け取る
海外では経済的に余裕のない方がお金をかけず医療を受けるため治験へ参加しますが、日本は公的保険で手厚く補助してもらえるため、治験に参加せずとも医療を手軽に受けられます。
このような背景から、日本では試験に参加する人が集まりにくく、新薬の発売に費やすコストが増大しているのです。
そのため、日本国内において「あえて臨床試験に参加する」という行為は、医療への貢献度が非常に高いのです。
また試験への参加は一方的な社会貢献にとどまらず、謝礼金を受け取る形で参加者にもメリットがあります。通常の診療より詳しい検査を受けるため、自覚していなかった病気を発見できる場合も珍しくありません。
- 創薬に貢献して後世に優れた医療を残す
- モニターとして参加し、謝礼金を受け取る
- 金銭的な負担を負わずに医療の恩恵を受ける
上記に魅力を感じる方は、ぜひ一度モニターとして試験に参加してみてください。
実際にモニターとして参加した方の体験談を以下にまとめました。あわせてご一読ください。
治験参加者のリアルな体験談が集合!「つらい、危険」という印象の真実は




























